Тяжелая
Формулу воды знают даже те, кто прогуливал школьные уроки химии, а вот о ее тяжелой разновидности слышал далеко не каждый.
В статье простыми словами объясняется, что собой представляет тяжелая вода: в чем отличие от обычной «из крана», где используется, можно ли считать ее аналогом «мертвой воды» из детских сказок.
В статье приведен «рецепт» приготовления, немало интересных фактов, и даже разоблачаются распространенные заблуждения.
Содержание
- Что это такое?
- История открытия
- Каков состав и химическая формула?
- Является ли оксидом, изотопом?
- Как выглядит?
- Виды
- Почему дейтериевую воду D2O называют тяжелой?
- Можно ли пить?
- Что будет, если попадет в организм человека?
- Сравнение с легкой H2O
- Где применяется?
- Свойства
- Относительная молекулярная масса
- Как получают?
- Заключение
Что это такое?

Такой состав приводит к увеличению удельной массы на 10 % – делает молекулу воды тяжелее.
У жидкости есть другие названия – оксид дейтерия, тяжеловодородная или дейтериевая вода.
Она присутствует практически во всех естественных водах:
- в реках,
- морях,
- озёрах,
- атмосферных осадках.
Интересно, что в дожде дейтерия несколько больше, чем в снеге. Химическое взаимодействие в тяжелой воде осуществляется медленнее, водород в этой формуле сложнее отделяется от кислорода.
Согласно исследованиям, тяжелая вода отрицательно воздействует на представителей флоры и фауны. Однако ряд организмов выживает даже при 70% дейтерия – клетки бактерий, водорослей, грибов и некоторых растений способны адаптироваться к раствору оксида дейтерия. Среди рекордсменов по скорости адаптации – чайный гриб, инфузория-туфелька и хлорелла.
История открытия
Прогноз о существовании дейтерия давал известный ученый Э. Резерфорд. Но впервые молекулы тяжелой воды в составе природной обнаружил американский физик-химик Гарольд Юри – проводя в 1932 году опыты с выпариванием. За это открытие он был отмечен Нобелевской премией.
А спустя год его соотечественник Гильберт Льюис синтезировал чистый образец оксида дейтерия – в результате электролиза обычной воды. Ученый многократно пропускал электрический ток через остаток H2O, постепенно насыщая воду молекулами HDO и D2O – до тех пор, пока концентрация последних не достигла 99%.
Каков состав и химическая формула?
Химическая формула пишется D2O или 2H2O. В химии вещество представляет собой оксид – либо водорода 2H (вместо легкого водорода 1H (протия) в обычной воде), либо дейтерия D – тяжелого изотопа водорода, содержащего на один нейтрон больше, чем в стандартном случае.
Молекулярная масса оксида дейтерия D2O (2H2O) равна 20,027, а у простой воды H2O, для сравнения, – 18.
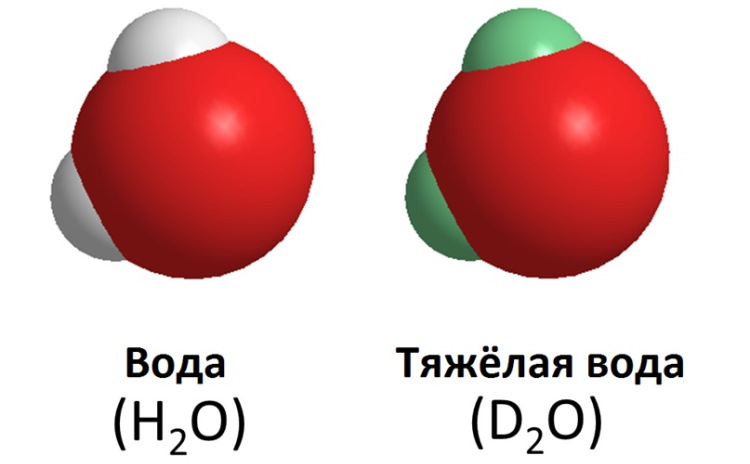
Является ли оксидом, изотопом?
Тяжелая вода – оксид дейтерия D2O с кислородом природного изотопного состава. Радиоактивными свойствами это соединение не обладает, в отличие от разновидностей – сверхтяжелой и тяжелокислородной вод.
Как выглядит?
Тяжелая вода выглядит совсем как обычная – это бесцветная жидкость без запаха. В природных источниках соотношение между дейтериевой и обычной водой составляет примерно 1:5500.
Виды
Тяжелая вода, в зависимости от атомного состава, имеет несколько разновидностей:
- Полутяжелая (гидроксид дейтерия, дейтериевая или монодейтериевая вода) – DHO или 2HHO. Дейтерием в этом случае замещен только один атом водорода.
- Сверхтяжелая. T2O имеет в составе тритий – радиоактивный изотоп водорода с периодом полураспада более 12 лет. Такая вода радиотоксична и еще сильнее отличается от обычной по физическим параметрам: закипает при 104 °С, замерзает при 9 °С, обладает плотностью 1,33 г/см3.
- Тяжелокислородные изотопные модификации воды. Термин«тяжелая вода» применим и в отношении тяжелокислородных вод, у которых обычный легкий кислород (16O) заменен одним из тяжелых стабильных изотопов (17O или 18O).
Теоретическое число подобных видов – более 100.
Почему дейтериевую воду D2O называют тяжелой?
В молекуле D2O вместо водорода присутствуют атомы дейтерия, которые отличаются от «типичного» водорода – в состав ядра атома кроме протона (ядра атома водорода) входит еще и нейтрон, «утяжеляющий» массу.
Можно ли пить?

Но лучше этого не делать: регулярное применение приведет к негативным последствиям.
Кстати, пришло время развенчать один миф. Долгое кипячение обычной природной воды не превращает ее в «тяжелую», не сказывается на здоровье человека. Это лишь миф: на самом деле концентрация D2O в прокипяченной даже несколько раз жидкости – ничтожно мала.
Ученые однажды решили выяснить – какой объем должен испариться из чайника, чтобы в остатке жидкости заметно увеличилась концентрация дейтерия. Оказалось – чтобы получить 1 л раствора с содержанием 0,15% дейтерия (что всего в 10 раз превышает природный показатель), в посуду нужно постепенно долить не менее 2,1⋅1030 тонн воды – объем, в 300 млн.раз превышающий массу Земли.
Гораздо в большей степени вкус и свойства воды при продолжительном кипячении зависят совсем от другого – от увеличения содержания растворенных солей, перехода в жидкость веществ из стенок чайника, термического разложения примесей органики.
Что будет, если попадет в организм человека?
Дейтериевая вода считается слаботоксичной. Человек может, не опасаясь за здоровье, выпить даже литр D2O – весь объем дейтерия выведется из организма естественным путем через неделю, а сам элемент не радиоактивен.
Однако к процессу подходят с большой осторожностью – существует высокий риск развития побочных эффектов. Употреблять регулярно раствор тяжелой воды нельзя. Постепенно, накапливаясь в организме, соединение будет нарушать целостность ДНК, замедлять метаболизм, ускорять появление необратимых возрастных изменений.
Это обернется отказом органов, появлением опухолей. Если же концентрация D2O достигнет 20% от общего объема циркулируемой в организме жидкости, вероятен летальный исход.
Дейтерий присутствует во всех биологических соединениях, в которых есть водород. В организме человека он тоже присутствует – в количестве, соответствующем 5 г тяжелой воды.
Оксид дейтерия опасен только при регулярном потреблении больших объемов. Но стоимость оборудования и производства оксида дейтерия высока, поэтому шанс встретиться с ним в повседневной жизни – минимален.
Сравнение с легкой H2O
Тяжелую воду по виду и органолептике трудно отличить от обычной – это такая же прозрачная и бесцветная жидкость без запаха. Отличия заметны только по вкусу: в ней как будто присутствует сахар – до степени, соответствующей 1/2 ч. л. на стакан воды.
Но по физическим свойствам дейтериевая вода кардинально отличается от обычной. Удельный вес на 10,7% превышает показатель H2O, вязкость – на 25%. Это основные физические различия.
Рассмотрим другие показатели в таблице:
| Показатель | D2O | H2O |
| Молекулярная масса | 20,027 | 18 |
| Плотность при 20°C (г/см3) | 1,1050 | 0,9982 |
| Температура кристаллизации (°C) | 3,8 | 0 |
| Температура кипения (°C) | 101,4 | 100 |
Кроме того, D2O быстро перемешивается с этанолом, но, к примеру, соль, растворяется в ней с трудом.
Дейтериевая вода гигроскопична: способна поглощать пары обычной жидкости на открытом воздухе.
Где применяется?
Ученые сначала не могли найти применение оксиду дейтерия – до тех пор, пока в 1938 не стал очевиден процесс деления ядер. После этого у тяжелой воды появилось промышленное значение, например, в ядерных реакторах.
Жидкость практически не поглощает нейтроны, регулирующие термоядерный синтез, поэтому используется для их торможения, а также в качестве носителя, который отводит тепло из зоны с цепной реакцией.
Перспективность применения оксида дейтерия в ядерных технологиях настолько высока, что его коммерческий оборот в некоторых странах жестко регулируется государственным надзором.
Такие меры позволяют предупредить теоретическую возможность создания неконтролируемых (и поэтому очень опасных) реакторов, работающих на природном уране, которые могут применяться для производства оружейного плутония.
Современные ученые видят в оксиде дейтерия большой потенциал в качестве источника «вечной энергии»: из единицы массы дейтерия можно извлечь энергии в 10 млн.раз больше, чем при сжигании того же количества угля.
Другие области применения D2O:
В химических процессах – в качестве изотопного индикатора.
- В физике элементарных частиц – для детектирования солнечных нейтрино.
- В медицине и биологии – для предупреждения быстрого размножения нежелательных и опасных микроорганизмов, бактерий, водорослей, грибов, высших растений.
Биологические свойства интересны, но еще мало изучены: воздействие D2O на живые организмы пока только исследуется. Вода со сниженной до 20% концентрацией дейтерия («бездейтериевая») обнаружила антимутагенные качества.
После серии экспериментов ученые получили неоднозначные результаты: в малых концентрациях тяжелая вода, вероятно, стимулирует жизнедеятельность, а в больших – парализует.
Если концентрация оксида дейтерия составляла (по различным данным):
- 20 % – домашние животные активно росли, набирая мышечную массу, куры эффективнее неслись, растения увеличивали количество семян;
- 30 % — живые организмы быстрее развивались, у них наступало раннее половое созревание, увеличивался сперматогенез;
- 70 % — наступало преждевременное старение – ухудшался обмен веществ, появлялись опухоли, фиксировался отказ некоторых органов и систем.
Сферы применения тяжелой воды рассмотрены в этой статье.
Свойства
Основные показатели дейтериевой воды:
- t кипения – 101,43 °C;
- t замерзания – 3,813 °C;
- плотность (при 25 °C) – 1,1042 г/см³ (максимальная – при 11,6°C);
- молекулярная масса – 20,034 г/моль.
Какими свойствами (плотностью и другими) обладает тяжелая вода, читайте здесь.
Относительная молекулярная масса
Молекулярная масса оксида дейтерия D2O (2H2O) равна 20,04 г/моль. Для сравнения – молекулярная масса простой воды H2O – 18 г/моль.
Как получают?

При электролизе обычной воды, в которой вместе с молекулами Н2О присутствует и незначительное число молекул D2O, образованных тяжелым изотопом водорода, разложению, в основном, подвергаются молекулы Н2О.
Поэтому при длительном воздействии тока жидкость постепенно насыщается молекулами D2O. Из такого остатка после многократных процессов электролиза почти 100 лет назад и удалось впервые выделить небольшой объем жидкости, на 99% состоящей из D2O, получившей название «тяжелой воды».
Затем появились методы ректификации жидкого водорода и различные модификации технологии изотопного обмена.
Производство дейтериевой воды энергоемко, поэтому себестоимость очень высока. При концентрировании дейтерия последовательно применяется цикл различных методов – начиная от сравнительно недорогих, со значительными потерями жидкости, заканчивая более энергозатратными, но с меньшими потерями.
В промышленном производстве используется вода, многократно дистиллированная из электролита, с содержанием D2O до 0,2 %. На первом этапе применяется сероводородная технология изотопного обмена, с концентрацией оксида на выходе 5–10 %. На втором – каскадный электролиз щелочного раствора, с доведением концентрации до 99 %.
Самым крупным производителем D2O является Канада – государство, применяющее в энергетике тяжеловодные ядерные реакторы CANDU.
Чтобы в домашних условиях выделить незначительный объем малоконцентрированного D2O, используют качество дейтериевой воды замерзать при 3,8 °C и процесс охлаждения с последующей фильтрацией кристаллов льда:
- Очистить определенный объем природной воды от примесей – солей, хлора, марганца, железа.
- Нагреть жидкость до состояния «белого ключа» – до появления пара соответствующего цвета.
- Остудить, налить в емкость из стекла или металла, отправить в морозильную камеру.
- Замороженный лед частично разморозить, собрать талую воду со дна посуды.
- Повторить несколько раз, пока концентрация дейтерия не увеличится.
Затем проводится фракционная перегонка, в результате которой можно получить чистый оксид дейтерия. Но на создание 1 л нужного раствора затрачивается около 60 тыс. кВт⋅ч электроэнергии, что равнозначно потребности при производстве 3 т алюминия. Подробности — в этой статье.
Заключение
Тяжелая вода активно используется в самых различных сферах – в ядерных технологиях, химической промышленности, экспериментальной медицине.
Ученые подбирают различные пропорции D2O в исследованиях, направленных на улучшение приплода и увеличение массы животных, а также на борьбу с раковыми опухолями.
При дальнейших экспериментах возможно открытие новых качеств этой жидкости – не исключено, что мы живем в эпоху научных прорывов.

 В химических процессах – в качестве изотопного индикатора.
В химических процессах – в качестве изотопного индикатора.


